2020年美国糖尿病协会(ADA)新发布的《糖尿病医学诊疗标准》中引入了一个全新评价血糖控制的标准——葡萄糖目标范围内时间(Time in Range,TIR)[1],明确了其在血糖评估中的重要地位。不仅如此,欧美多个糖尿病国际学术机构已于2019年6月联合发布了《TIR国际共识推荐》[2],用于指导TIR的临床运用。2023版ADA指南指出,TIR与微血管并发症的风险相关,可用于评估血糖控制[23]。那么,TIR究竟是什么?为什么它会成为血糖评估的新指标?如何才能提高TIR?接下来,我们一起探寻这些问题的答案。
WHAT:TIR是什么?

根据《TIR国际共识推荐》[2],TIR指的是糖尿病患者在一天之中,血糖控制在目标范围内[70~180 mg/dl(3.9~10.0 mmol/L)]的时间。相应地,TIR还衍生出了另外两个概念:TBR——葡萄糖低于目标范围范围(<3.9 mmol="">10 mmol/L)时间。
TIR的产生与持续葡萄糖监测(CGM)技术密切相关,大部分CGM系统生成的动态血糖图谱(AGP)可以提供包括TIR在内的多种参数信息(图1),医务人员可从AGP报告上直接读取血糖在不同范围(在目标范围内、在目标范围之下、在目标范围之上)的时间和比例[1]。
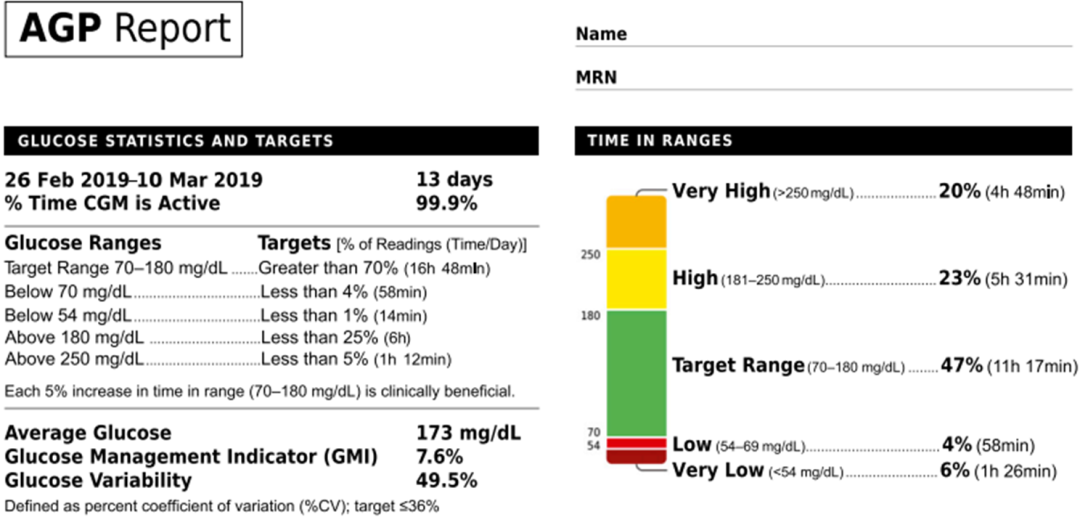
图1. CGM系统生成的AGP报告
与HbA1c类似,TIR控制目标也宜个体化。《TIR国际共识推荐》针对四类患者人群,确定了个体化的TIR目标值,对于一般2型糖尿病(T2DM)患者,建议血糖在3.9~10.0 mmol/L范围内时间占比超过70%,低于3.9 mmol/L的时间占比应小于4%。
WHY:
为什么TIR成为血糖评估的新指标?

TIR是CGM技术的产物之一,CGM系统已于1999年获得美国食品药品监督管理局(FDA)批准,2001年获我国国家食品药品监督管理总局(CFDA)批准并应用于临床中[3],它的广泛应用推动了TIR这一指标的研究与发展。除了技术的支持,TIR本身具有什么优势,足以使之成为权威指南推荐的血糖评估新指标呢?

01

TIR弥补HbA1c的不足
HbA1c一直被认为是血糖评估的金标准,其反映了过去2~3个月的平均血糖水平,且与并发症风险密切相关,在糖尿病管理中具有重要价值。但是,HbA1c仍然存在一定的局限性,如缺乏急性高/低血糖相关信息,无法反映血糖波动等[4]。此外,贫血、血红蛋白病、缺铁或妊娠还会影响HbA1c的测量[5-7]。
鉴于此,新指标TIR越发受到关注,TIR及其他衍生指标可以更好地反映短期血糖变异程度[8],有效弥补HbA1c的不足,两者联合使用可以更全面地反映血糖控制情况。

02

TIR与HbA1c具有良好的相关性
TIR不仅可以有效弥补HbA1c的不足,还与HbA1c具有良好的相关性。一项纳入18项随机对照研究的系统性综述[9]显示,在糖尿病患者中,TIR与HbA1c之间存在良好的线性关系(R=-0.84,R2=0.71),TIR每增加10%(每天2.4小时),相当于HbA1c下降约0.8%。这种关系使得TIR可能成为评估血糖控制的首选指标。

03

TIR预测糖尿病并发症的发生风险
通过控制血糖而减少并发症的发生发展,是糖尿病长期管理的目标。那么,TIR是否可以预测糖尿病并发症的发生风险呢?对此,国内外相关研究给出了肯定的答案。
最早关于TIR与T2DM并发症关系的研究是由我国贾伟平教授团队开展的。该研究纳入3262例T2DM患者,应用CGM评估TIR结果,并分析其与非增殖性糖尿病视网膜病变(NPDR)的关系[10]。研究发现,随着TIR四分位数的增加,各严重程度NPDR的患病率均显著下降(趋势P值<0.001)(图2),且dr严重程度与tir四分位数呈显著负相关(r=-0.147,P<0.001)。<>
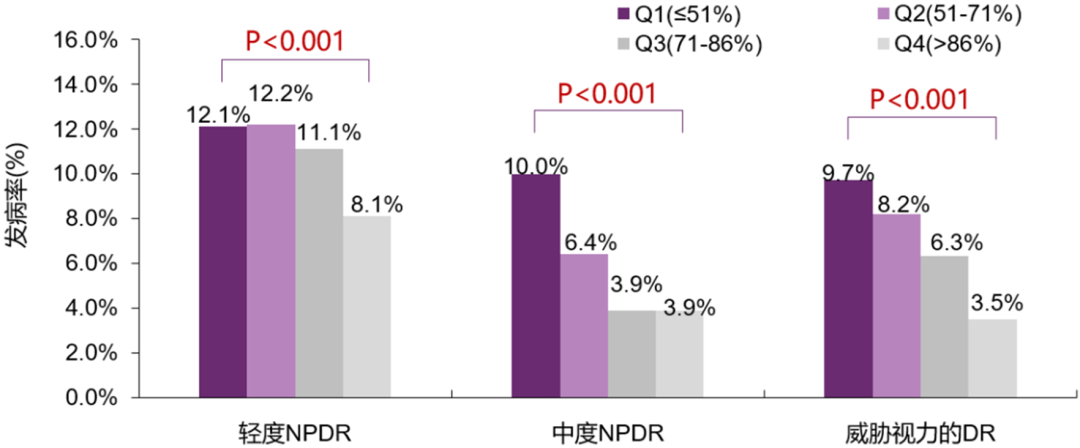
图2. TIR(3.9~10.0 mmol/L)与DR进展呈显著负相关
随后,美国Jaeb健康研究中心Beck教授利用DCCT数据,分析了TIR与糖尿病并发症进展的相关性[11]。结果发现,TIR与DR进展和微量白蛋白尿的发展呈强相关性,TIR越大,相关并发症风险越低(图3)。使用风险模型评估发现,TIR每降低10%,DR和微量白蛋白尿风险分别增加64%和40%。
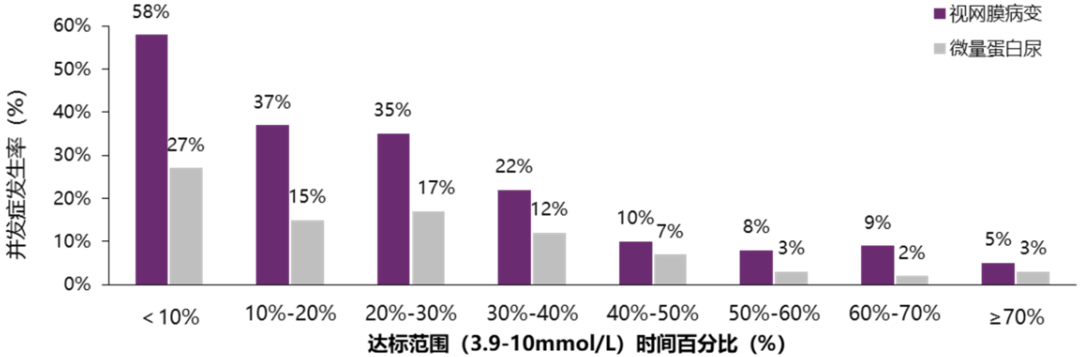
图3. TIR与视网膜病变进展和微量白蛋白尿的发展呈强相关性
除了预测微血管并发症的发生,TIR与心血管疾病(CVD)风险也存在关联。贾伟平教授团队最新研究成果显示,TIR与CVD的早期指标颈动脉内膜中层厚度(CIMT)密切相关[12]。在纳入的2215例T2DM住院患者中,CIMT异常患者的TIR显著低于CIMT正常者(P<0.001),异常cimt的发生率随tir增加而逐渐降低(趋势P值<0.001)(图4)。在校正cvd的常规风险因素后发现,tir每增加10%,cimt异常风险降低6.4%。<>
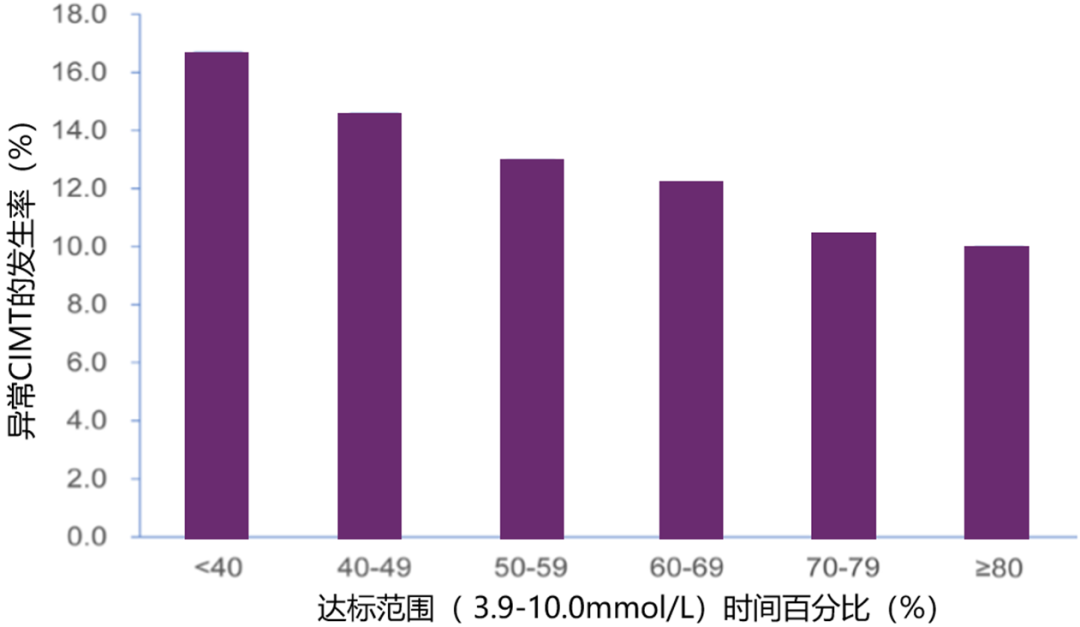
图4. 异常CIMT的发生率随TIR增加而逐渐降低

04

TIR可能预测糖尿病的逆转
短期胰岛素强化治疗(SIIT)可逆转初诊T2DM患者的β细胞功能紊乱,诱导疾病缓解。2020 ADA大会上李延兵教授团队发布了SIIT治疗期间TIR与糖尿病缓解率的关系研究[13]。该研究在95例新诊断T2DM患者中进行,行SIIT治疗2~3周。停药1年后发现,糖尿病缓解率在TIR≥70%人群中显著高于TIR<70%人群(图5)。在逻辑回归模型中,校正年龄、bmi和基线hba<>1c后,TIR≥70%与停药1年时糖尿病缓解率较高显著相关(OR 2.60,95%CI:1.10~6.13,P=0.03)。该结果表明,对于新诊断T2DM患者,SIIT治疗期间的高TIR数值预示β细胞功能恢复更好,更有可能发生糖尿病逆转。
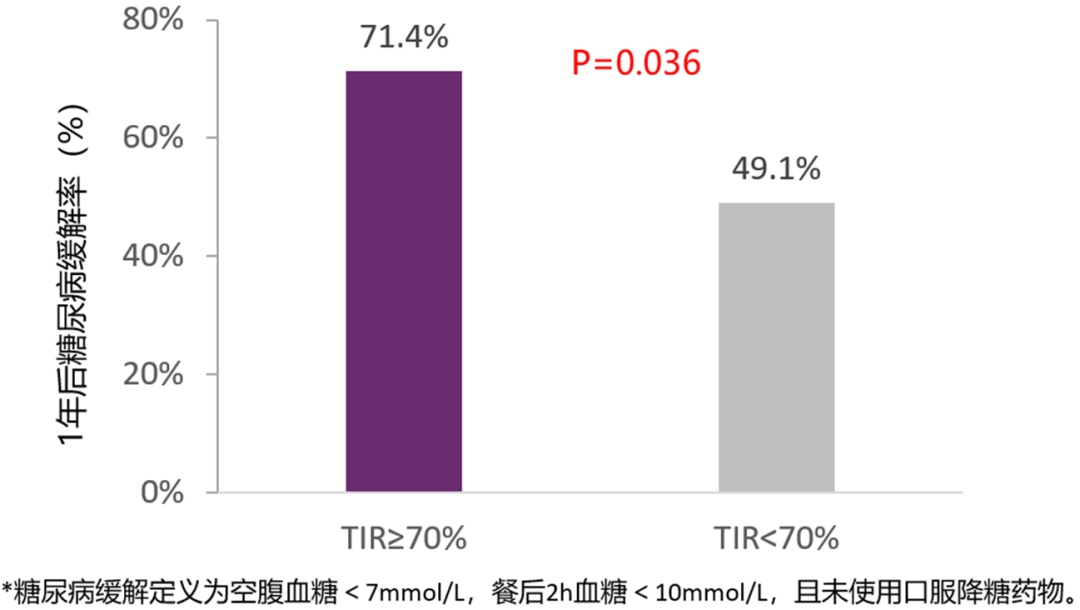
图5. SIIT期间TIR≥70%的患者1年后糖尿病缓解率更高
综上所述,TIR可以弥补HbA1c的不足,且与HbA1c具有良好的相关性,能预测糖尿病并发症的发生风险以及预测糖尿病逆转,这些优势使其成为临床血糖评估的新指标。
HOW:如何提高TIR及改善相关指标?

TIR反映了血糖控制程度,且与并发症风险密切相关,故积极提高TIR至关重要。目前,随着CGM技术的成熟,聚焦于提高TIR或改善相关指标(TAR与TBR)的临床研究也越来越多。

01

降糖药物对TIR及相关指标的积极作用
降糖药物是改善血糖控制的有力武器,与传统降糖药物二甲双胍、磺脲类等相比,较为新型的降糖药DPP-4抑制剂和SGLT2抑制剂更受关注。
DPP-4抑制剂已被广泛研究证实可以显著降低血糖,且不增加低血糖等不良反应风险[14,15],这种降糖效果也可能改善TIR或相关指标。国内一项随机对照试验分析了DPP-4抑制剂沙格列汀对TAR与TBR的影响[16],该研究共纳入72例糖尿病患者,所有患者给予胰岛素4次强化治疗并采用CGMS连续监测血糖3天,3天后随机分为沙格列汀组和对照组。对照组继续应用上述降糖方案,沙格列汀组则在此基础上加用沙格列汀5 mg/d。结果显示,治疗13~15天,沙格列汀组的TAR显著降低16%,TBR显著降低36%(图6)。
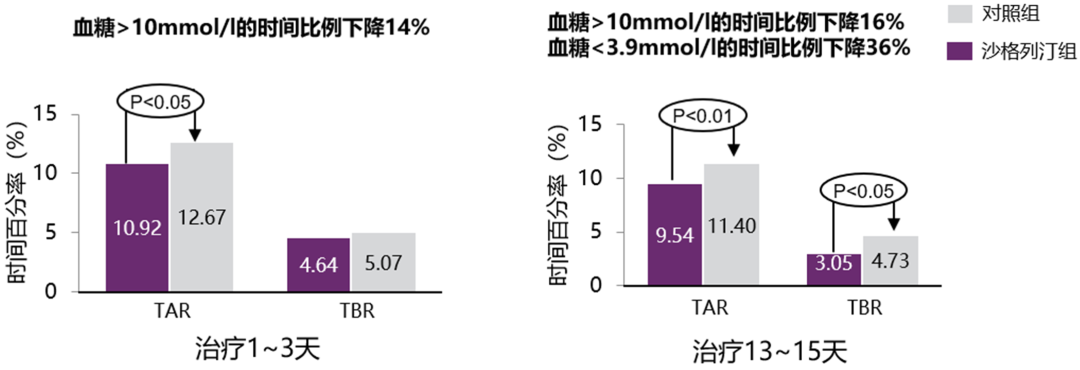
图6. 加用沙格列汀可显著降低TAR与TBR
除DPP-4抑制剂外,SGLT2抑制剂因兼顾降低血糖、改善代谢危险因素、保护心肾等多项优势而被深入研究[17-19]。近期已有研究证实,SGLT2抑制剂可显著提高TIR。一项纳入100例血糖控制不佳T2DM患者的研究显示,与安慰剂相比,达格列净治疗4周后TIR显著增加(69.6% vs. 52.9%,P<0.001)<>[20]。另一项阳性对照研究表明,达格列净改善TIR的作用优于磺脲类[21]。该研究纳入97例未经药物治疗或稳定剂量二甲双胍单药治疗的T2DM患者,随机接受达格列净10 mg或格列齐特缓释片120 mg治疗12周。结果发现,达格列净组改善TIR作用显著优于格列齐特缓释片(图7)。2023 ADA年会上公布的MAGNNIFY研究纳入新诊断T2DM患者,按1:1比例随机分配接受达格列净10 mg+二甲双胍2000 mg联合治疗或二甲双胍2000 mg单药治疗,疗程为12周。结果显示,起始达格列净+二甲双胍联合治疗能够改善新诊断T2DM患者的血糖变异性(图8)[24]。

图7. 达格列净改善TIR作用显著优于格列齐特缓释片

图8. 起始达格列净+二甲双胍联合治疗改善新诊断T2DM患者的血糖变异性

02

CGM新技术有助于提高TIR
近年来,CGM技术不断突破更新,实时持续葡萄糖监测(rtCGM)等新技术逐步应用于临床。与传统CGM相比,rtCGM可以实时显示即刻血糖值和血糖变化趋势,并设有高低血糖预警机制,这可能有助于及时调整治疗方案以改善血糖控制[4]。2019年欧洲糖尿病研究协会(EASD)年会上报道的一项为期12周的单臂观察性研究[22]显示,与传统CGM相比,rtCGM可以显著提高TIR(49.6% vs. 42.5%,P<0.001),混合效应模型分析显示rtcgm的使用与tir较高显著相关(P=0.0002)。
综上所述,TIR已经在糖尿病相关临床研究中崭露头角,研究结果令人鼓舞,对HbA1c的血糖控制金标准地位发起了挑战,有望改变糖尿病的管理评价模式。SGLT2抑制剂、DPP-4抑制剂以及CGM新技术均有助于提高TIR或改善相关指标,这些研究成果为药物或技术结合TIR的临床运用提供了有力支持,为血糖管理提供了新思路。
参考文献
1. Diabetes Care. 2020; 43(Suppl 1): S1-S212.
2. Battelino T, et al. Diabetes Care. 2019; 42(8): 1593-1603.
3. 中华医学会糖尿病学分会. 中华糖尿病杂志. 2017; 9(11): 667-675.
4. 司一鸣, 等. 中华糖尿病杂志. 2018; 10(6): 386-389.
5. Bry L, et al. Clin Chem. 2001; 47(2): 153-163.
6. Ford ES, et al. J Diabetes. 2011; 3(1): 67-73.
7. Nielsen LR, et al. Diabetes Care. 2004; 27(5): 1200-1201.
8. Vigersky RA. J Diabetes. 2019; 11(1): 23-31.
9. Vigersky RA, et al. Diabetes Technol Ther. 2019; 21(2): 81-85.
10. Lu J, et al. Diabetes Care. 2018; 41(11): 2370-2376.
11. Beck RW, et al. Diabetes Care. 2019; 42(3): 400-405.
12. Lu J, et al. Diabetes Technol Ther. 2020; 22(2): 72-78.
13. Presented at the American Diabetes Association 80th Scientific Sessions, 1032-P.
14. Park H, et al. Ann Pharmacother. 2012; 46(11): 1453-1469.
15. Ling J, et al. Acta Diabetol. 2019; 56(3): 249-272.
16. 李征寒, 等. 中国医药导报. 2017; 14(10): 70-73, 84.
17. Scheen AJ. Drugs. 2015; 75(1): 33-59.
18. Wiviott SD, et al. N Engl J Med. 2019; 380(4): 347-357.
19. Mosenzon O, et al. Lancet Diabetes Endocrinol. 2019; 7(8): 606-617.
20. Henry RR, et al. Diabetes Technol Ther. 2018; 20(11): 715-724.
21. Vianna AGD, et al. Diabetes Obes Metab. 2020; 22(4): 501-511.
22. Presented at the EASD 2019, ePoster #834.
23. Diabetes Care. 2023; 46(Suppl. 1): S97-S110.
24. A.P. Guerrero-castillo. 885-P. ADA 2023.
审批编号:CN-118992,有效期至2023-10-23
内容由阿斯利康提供,仅供医疗卫生专业人士参考
声明:本文仅供医疗卫生专业人士了解最新医药资讯参考使用,不代表本平台观点。该等信息不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议,如果该信息被用于资讯以外的目的,本站及作者不承担相关责任。
(来源:《国际糖尿病》编辑部)
版权声明
版权属《国际糖尿病》所有。欢迎个人转发分享。其他任何媒体、网站未经授权,禁止转载。



