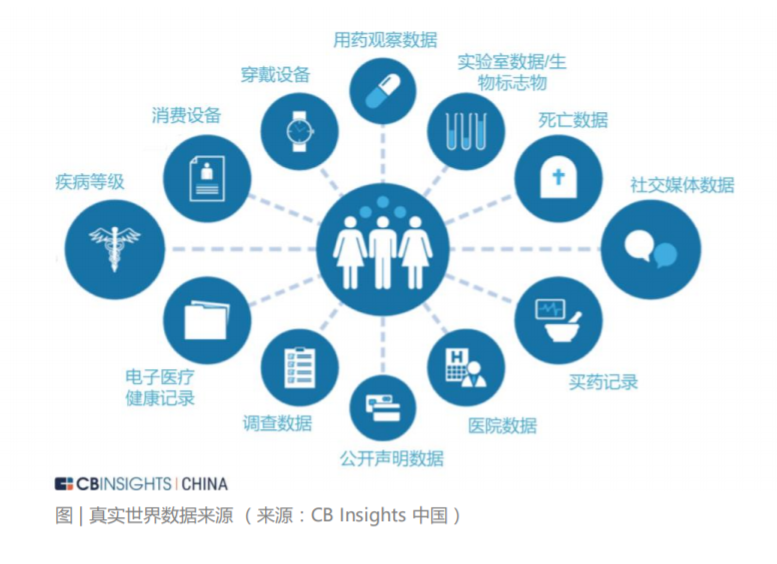
真实世界数据相关解决方案的价值体现主要在其数据价值和应用价值两方面。与此同时,其价值的展现也为其在资本市场带来了极高的关注度。真实世界数据的类型丰富,数量庞大。以肿瘤为例,传统RCT中常规涉及到的患者大多不及目标患者群的5%。剩余95%的信息都埋藏在巨大的真实世界患者群体里,这也是RWD最大的数据资产和宝库。RWD常见来源包括:卫生信息系统(Health Information System,HIS),医保系统,疾病登记系统,国家药品不良反应监测哨点联盟(CASSA),自然人群队列数据库,组学相关数据库,死亡登记数据库和来自移动设备端的数据等。RWS 有机会将无序的医疗大数据“变废为宝“,并从中挖掘出有价值的医疗洞 见。基于互联网技术延伸出的现有医疗大数据关注切入点是数据,从数据角度出发 所积累的数据往往是无机的,分散的。而 RWD 的切入点是真实世界,是对真实世 界更有目的的,结构化的,诊疗旅程的记录。因此RWD的研究有望让分散分布的 互联网医疗数据获得结构化的处理,进一步提高医疗大数据整体质量从而挖掘出药 物或者其它干预措施在真实世界中的效果,使沉默已久的医疗大数据产生新的价值。从分析的角度, 高质量、多维度的 RWD 能发挥更高的价值与影响。虽然 RWE 在整个新药研发环节中有望释放重大价值,但真正实现其价值潜力则取决于 RWE 分析所依据数据的质量。明确界定哪些数据被认为是足够的,出于什么 目的,是确保 RWE 价值所必需的。用于假设生成或内部发展决策目的的数据可能 不需要与直接告知患者、付款人或监管机构行为的数据有相同的质量标准。监管级 别的 RWE, 或来自数据和分析的证据,用于监管机构(如 FDA 和欧洲药品管理局)审查,或用于国家付款人审查(卫生技术评估机构),必须经受最高级别的审 查(即 FDA 科学调查办公室的潜在审查)。关于高质量数据和分析的具体方面的 监管指南目前仍在制定中。在没有官方指导的情况下,其他人提出的原则——可 追踪/可审计、完整、透明、可归纳、及时和可扩展为这方面的发展提供了一个良好的起点。理想情况下,此类标准将由生物制药公司、监管机构和 RWE 数据提供商合作制定。FDA 与 RWE 供应商的示范项目,如 ASCO 的 CancerLinQ 和 Flatiron Health, 以及通过 Duke Margolis 健康政策研究中心 RWE Collaborative 举行 的行业圆桌会议,均是在这一领域持续努力的代表。FDA 正在接受 RWE 作为正 式指导之前提交的监管文件的一部分,并以此指导未来研究。低质量的 RWE(反 映数据或分析不足)对其广泛采用构成了最大的风险。利益相关者之间经过深思熟 虑的协作可以帮助定义在 RWE 的开发和使用中什么是最佳实践。 目前生物医药领域的真实世界数据大致可以分为临床数据、生物数据和健康管理数据三类。对药物研发而言,更有价值的 RWD 是需要经过严格且系统的数据收集和 处理而产生的高质量、多维度的数据。从某种程度上看,基于生物体的复杂性,单 一维度的分析往往不能成为强有力的佐证,而充分汇集以患者为中心的包含生物数 据、临床数据和健康管理数据三个层次的 RWD 对生物医药领域的研发更具价值。此外,对于同一个研究,其数据量越多则可能越有代表性,但若 RWS 的样本量较 小,也可以通过挖掘数据采集的深度,或在算法创新性方面做探索。此外,标准化的数据处理流程有望提高 RWD 挖掘医疗价值的效率。例如 AI 制药 企业晶泰科技的晶型预测、亲和力预测等算法,可以通过基于物理模型的高精度计 算直接补充虚拟数据,然后用来训练 AI。这类数据的质量和数量通常很高,在这 个基础上建立的模型也非常精确。但是在细胞、组织或者器官层面上的数据作用规 律就不一样了。RWD 本身来自真实世界,如果能够在基因、细胞、组织和器官多 维度上进行一定的标准化推广,无疑也会加速 RWD 行业朝着更加精准、智能、高 效的方向发展。晶泰科技自建实验室和数字孪生系统、并广泛与具有较强数据产生 能力的生物公司合作,正是这一方向的尝试。
多维度、高质量的真实世界数据在生物医药领域的日常实践中展现出来巨大的应用 潜力。在 RWD 的观念未被大家关注之前,药物药械研发以及基础研究都是通过 RCT 后进而向医疗实践单向输出,医疗实践板块反向回馈的信息非常有限。RWD 的概念被大众关注后,医疗实践板块被带动起来,和药物药械研发以及基础研究形 成了三位一体的联动结构,直接填补了效力-效果差,并可促进基础研究的转化。这种联动效应也带来了更丰富的高质量数据,可以向药物监管方实施反馈。综合分 析, RWD 的应用丰富了医疗价值链并且逐步从上市后的药效评估,往上游拓展。这里将着重分析 RWD 在药物上市前的研发环节可能的作用,分为辅助药物药械研 发,促进基础研究转化和辅助监管决策的制定三个方面。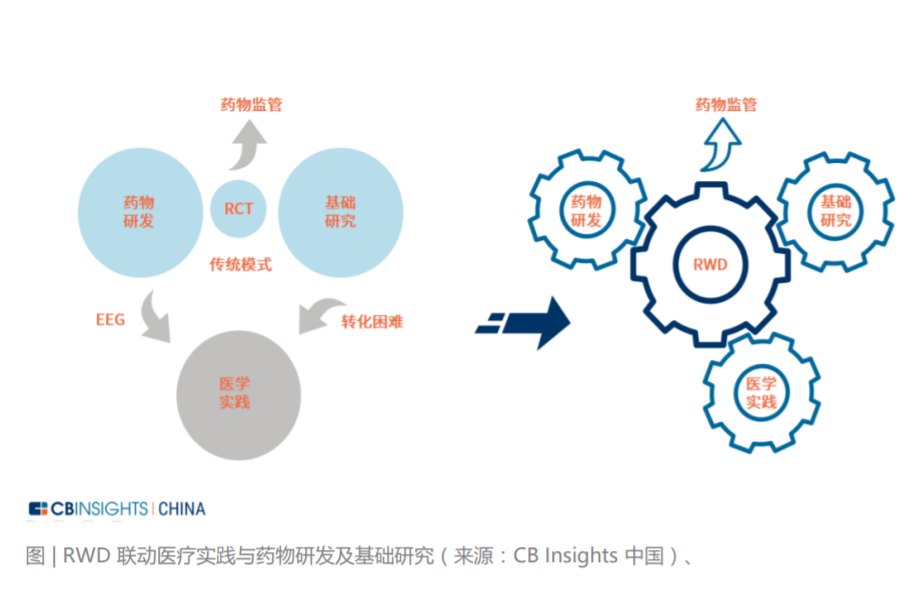
- 辅助罕见病药物研发:罕见病治疗药物临床试验除病例稀少、招募困难外,最大的挑战是对照的选择。因此,以自然疾病队列形成的真实世界数据就可以作为外部对照。2017年 FDA 加速批准PD-L1 抗体Avelumab,用于≥12岁进 行性转移性默克尔细胞癌(MCC)患者。案例中美国 FDA 首次基于电子健康 记录来源的 RWE 支持药物获批。批准上市主要基于一项单臂二期临床试验, 包括 35 个癌症中心的 88 名患者观察到ORR 33%和86% 持久应答率(≥6个月),还包括来自 iKnowMed数据库的历史数据。
- 修订适应症或联合用药范围,或为已上市药物的说明书变更提供证据:当 RCT 不可行或非最优的研究设计时,采用 PCT 或观察性研究等生成的真实世 界证据支持新增适应症可能更具可行性和合理性。2019 年 4 月,美国 FDA 批准辉瑞乳腺癌疗法 Ibrance(palbociclib)与芳香酶抑制剂或氟维司群 (fulvestrant)联用,治疗 HR+, HER2- 晚期或转移性男性乳腺癌患者。这 一批准并不依赖于临床研究,而是基于电子病历和药物上市后真实世界中男性 患者使用 lbrance 的数据。
- 辅助中医经验方、中药医疗制剂的研发:对于名老中医经验方、中药医疗机构制剂等已有人用经验药物的临床研发,在处方固定、生产工艺路线基本成型的 基础上,可尝试将真实世界研究与随机临床试验相结合,探索临床研发的新路 径。2019 年,广州市大湾区中医药真实世界研究中心成立。这是中国第一所 专注于基于家庭医生开展中医药真实世界研究的科研机构,旨在将真实世界研 究的方法论运用到中医药行业,支持中医药事业传承创新发展,推动中医药走向现代化。
- 辅助医疗器械研发:临床急需进口器械在国内使用,可用真实世界数据,作为 已有证据的补充,用于支持产品注册。2019 年 6 月,国家药监局与海南省人民政府联合启动了海南临床真实世界数据应用试点工作,探索将临床真实世界 数据用于药品医疗器械产品注册和监管决策实践。2019 年 12 月起,美国艾尔 建公司“青光眼引流管”产品开始收集用于评估人种差异的境内临床真实世界 证据,并与 2020 年 3 月成为国内首个通过该途径获批上市的医疗器械产品。
- 真实世界数据可加速药物上市:2021 年 4 月 7 日,欧康维视生物宣布其核心品种——治疗慢性非感染性葡萄膜炎产品 OT-401(氟轻松玻璃体植入剂)的新药上市申请正式获国家药监局受理。其公司提交给国家药监局的申报资料, 是 OT-401 在海南博鳌乐城国际医疗旅游先行区真实世界数据研究中的 28 例 受试者数据,以及该药品在境外已经完成的三期临床试验数据。这是中国药品 注册史上第一个完全基于真实世界研究数据申报上市的新药。真实世界数据研 究使这款药的商业化进程大约加快一年半。
高质量的 RWD 可以辅助生物医学基础研究,促进转化医学发展- 促进已发现生物标志物的临床转化:生物标记物的发现多始于基础研究,从发 现到临床应用仍需要一段较长的过程。用真实世界数据辅助生物标志物的临床 转化仍处在研究的初期,但是在 ClinicalTrial 上已经有相关案例。阿斯利康与 德国图宾根大学在 2017 年 3 月 - 2019 年 5 月展开了关于国际乳腺癌生物标志物护理标准的真实世界结果研究。比利时根特大学医学院 2021 年 1 月启动 了动态增强 CT(DCE-CT)作为治疗胸腔肿瘤监测的早期生物标志物的真实世 界研究,预计 2022 年 12 月终止。两项研究都是用真实世界数据进一步辅助 促进了已发现的生物标志物的临床转化。
- 促进新生物标志物的发现:在真实世界数据库中,用更多的患者样本和亚群体, 不仅可以加快已有生物标物的临床落地,还可以通过多组学分析寻找新的生物 标志物。2020 年美国食品和药物管理局器械与放射卫生中心在《临床转化医 学》上公开发表文章,用计算机模拟研究说明了基于 RWD 的证据方法,可能 有助于成本/时间效率高的生物标志物发现,从而为医疗产品的使用提供信息。
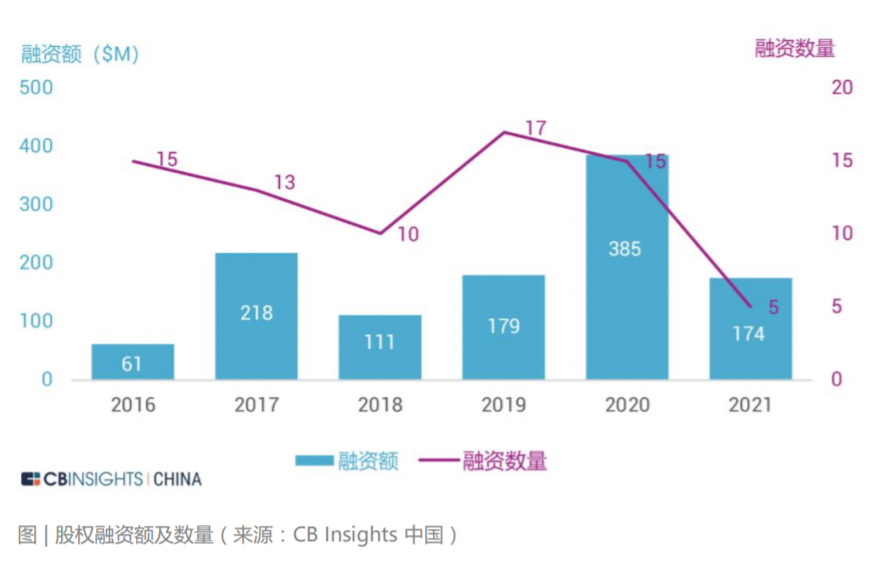
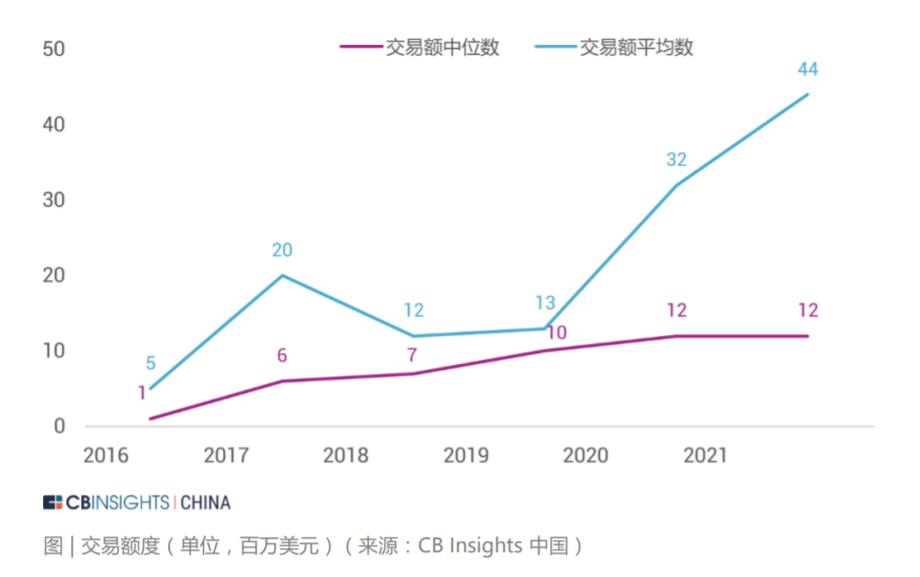
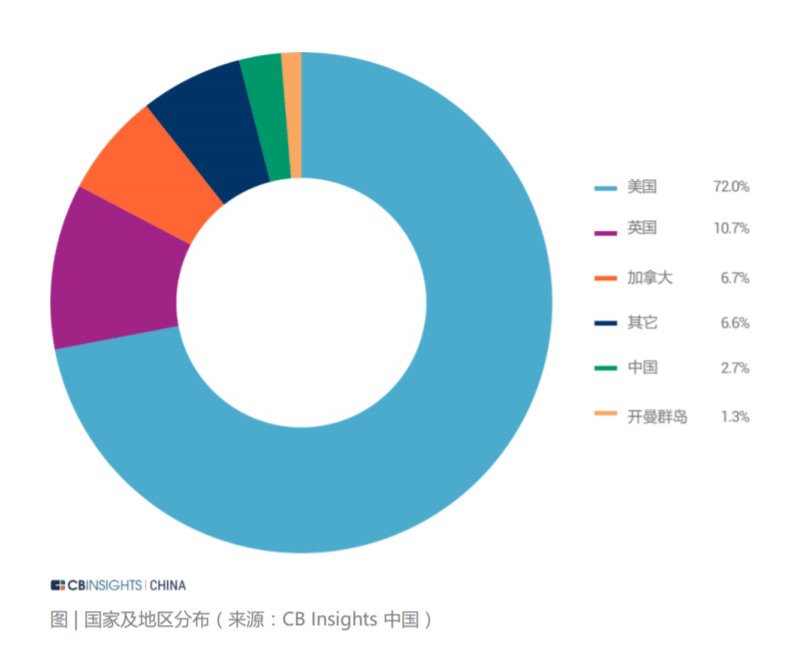
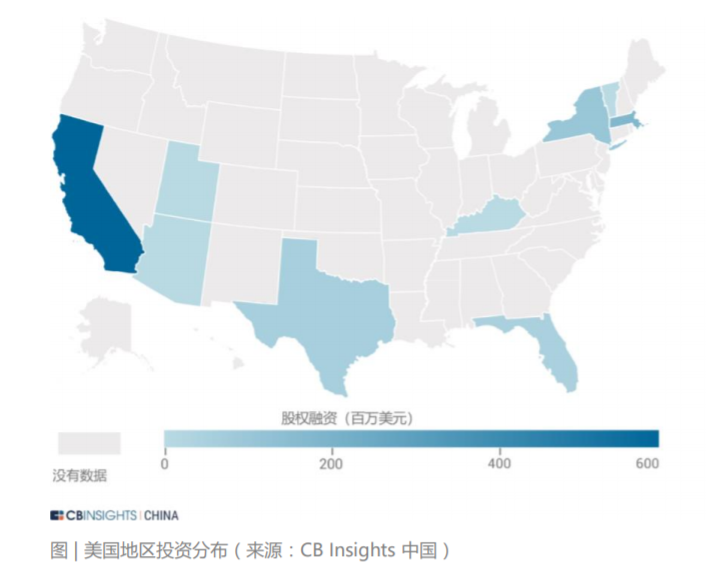
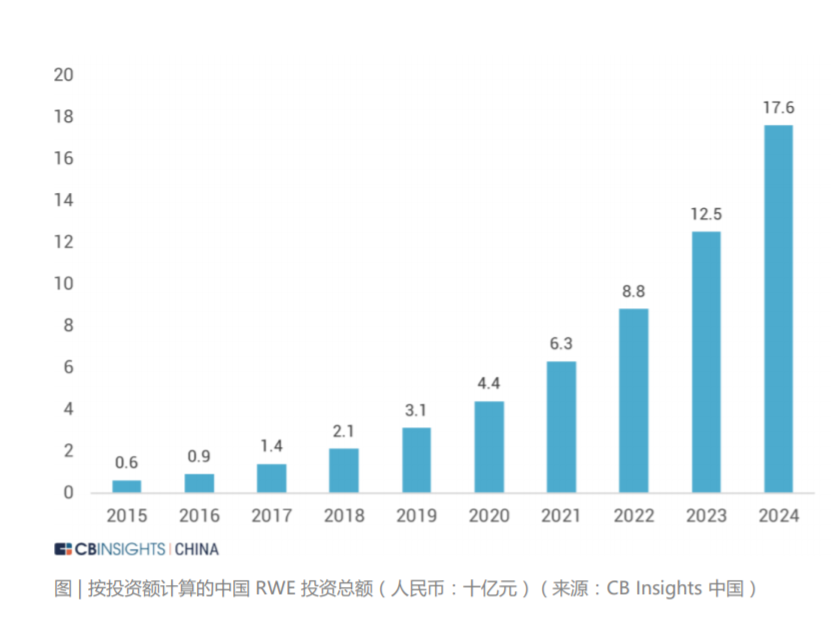
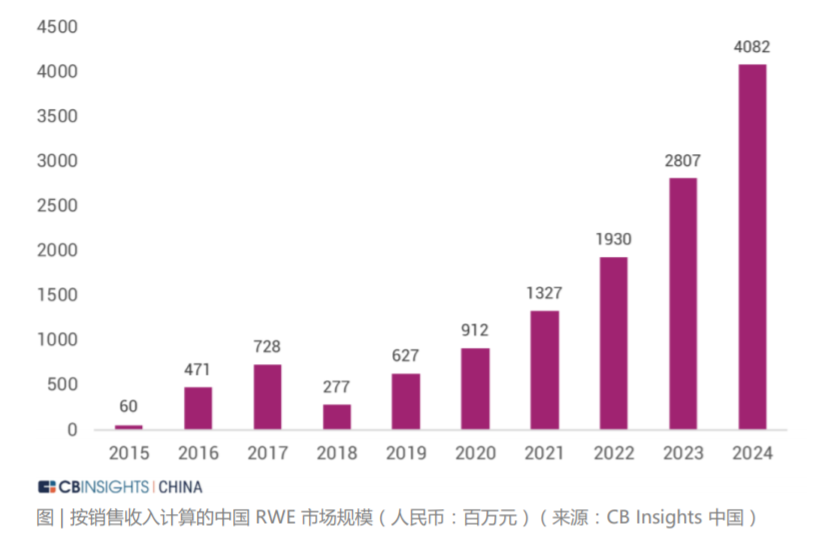
我国系统性开展使用真实世界证据支持药物研发和监管决策的工作尚处于起步阶段。但国家药监机构在审评实践中已经开始应用真实世界证据,例如 2018 年批准的扩 展贝伐珠单抗(bevacizumab)联合以铂类为基础的化疗方案,采用三项回顾性 研究结果作为真实世界证据支持最终决策。2020 年 3 月 26 日,国家药品监督管理局经审查,批准了美国艾尔建公司“青光眼引流管”产品的注册,成为国内首个使用境内真实世界数据的医疗器械产品。2021 年 3 月,国家药监局已批准普拉替 尼上市,用于既往接受过含铂化疗的 RET 基因融合阳性的局部晚期或转移性非小细胞肺癌 (NSCLC) 成人患者的治疗。该药成为中国首个获批上市的 RET 抑制剂, 同时也是国内首个使用真实世界数据辅助临床评价获批的药品。“青光眼引流管”从申请到注册上市历时不到5个月,而在过去,国际先进药械产品至少需要3到5 年的“长跑”才能进入国内市场,利用真实世界数据帮助监管部部门决策,从而也大大加速了药械的研发。 真实世界解决方案应用场景的丰富性和充足的想象空间带来了巨大的资本关注度。 在二级市场,根据 IQVIA 2020 年年报中的市场分析和行业预测,真实世界数据相 关解决方案的市场规模约为 800 亿美元。其中一部分是包含了约 400 亿美元的真 实世界证据市场,包括传统定义的分析平台和实施、医疗和科学分析服务、观察研 究和市场准入。另一部分则是约 400 亿美元与互联医疗保健相关的市场,包括收 益周期管理、支付者分析和临床决策支持服务等领域。 在一级市场,与真实世界解决方案相关的投融资状况同样保持火热。CB Insights 统计了 2016 年至 2021 年期间 102 家真实世界数据相关解决方案公司的投融资 情况。其中与真实世界数据相关的一级市场交易额持续走高,在 2020 年达到了近 年来最高的 3.85 亿美金。在融资轮次分布上,种子轮、A 轮和 B 轮的交易占比较高。可以看出目前整个 RWD 行业处在早期萌芽阶段,资本交易较为活跃。另外,从 2016 年到 2021 年每笔融资交易额的中位数持续高于融资均值,行业呈 现出一定的头部效应,优质企业获得估值溢价。从 RWD 企业在全球的地区分布来看,美国是交易的主战场,占据了全球 72% 的 份额,英国、加拿大、中国等地区紧随其后。在美国,西海岸地区的交易最为密集,这也从侧面展现出了该区域极强的科技创新 能力,是企业落地的优选之地。在中国,RWE 领域的发展也迎来了良机,投资总额逐年攀升。根据安永报告,预 计到 2024 年中国 RWE 投资总额可达 176 亿人民币。按销售收入计算的 2019 至 2024 年复合年增长率可达 45% 左右。此外,在“4+7”带量采购,国家税务监管严控等政策出台后,药企的营销模式 发生变化,传统的带金销售模式逐步转化为新型的学术销售模式 ,药企将更多营销费用投入上市后临床研究和真实世界研究等学术活动策略上。根据 2018 年国内前十大药企销售费用规模,2018 年 A 股药企销售费用合计约 2500 亿元 ,估算国 内上市后研究的市场规模至少在 1000 亿元以上 。预计每年中国上市后研究投入的 20% 将用于信息化和大数据分析,保守估计市场规模在200亿人民币。声明:内容摘录于《生物医药领域的真实世界数据行业报告2021》,本报告版权归 CB Insights 中国所有