急性胸痛是临床上最常见的症状之一,是以胸痛为主要表现的一组异质性疾病群。急性胸痛临床表现不一、病情变化迅速、危险性差异悬殊、预后与疼痛程度不完全相关、救治时间依赖性强。对于急性胸痛患者,应早期诊断,危险分层,正确分流,科学救治。近日,由中华医学会急诊医学分会联合中国医疗保健国际交流促进会胸痛分会组织撰写的《急性胸痛急诊诊疗专家共识》正式发表,为急性胸痛的救治提供了指导。
急性胸痛病因繁多、病情严重性差异极大,不仅包括急性冠状动脉综合征(ACS)、以急性主动脉夹层(AAD)为主的急性主动脉综合征(AAS)、以急性肺栓塞(APE)为主的“急性肺动脉综合征”及张力性气胸等高危胸痛,也包括稳定性冠心病、胃食管反流病、肋间神经痛、神经官能症等中低危胸痛。
如何进行危险分层和病情评估?
胸痛病因繁多,需立即对胸痛的危险程度作出评估。致命性胸痛需要立即进入抢救流程,中危胸痛需动态评估与监测,低危胸痛需合理分流。
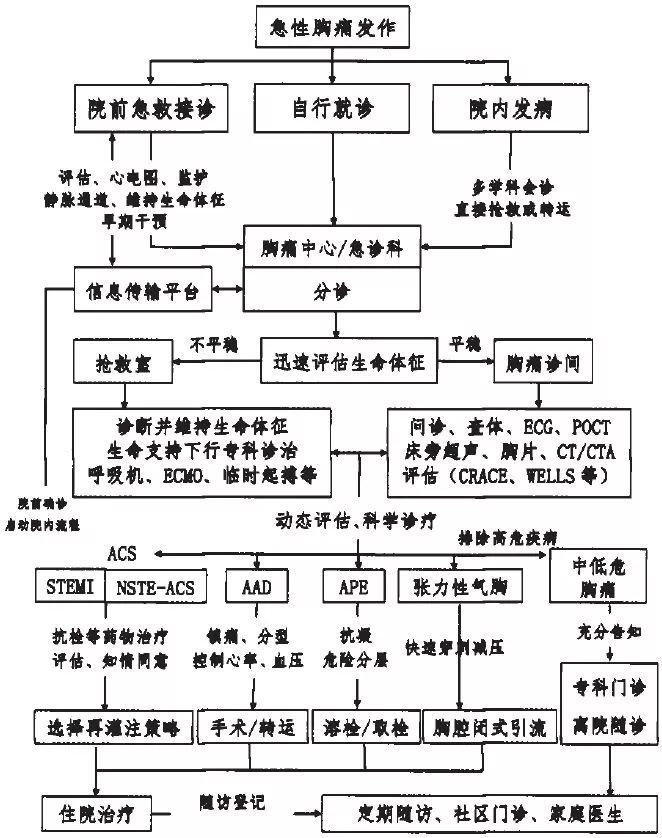
图1 急性胸痛诊疗流程图
1.急性非创伤性胸痛急诊分诊策略
胸痛且伴有下列任一情况者,应当立即进入监护室或抢救室:(1)意识改变;(2)动脉血氧饱和度低(<90%),呼吸衰竭;(3)血压显著异常;(4)影响血流动力学的严重心律失常;(5)既往有冠心病史,此次发作使用硝酸酯类药物不缓解;(6)既往有马凡综合征,伴有严重高血压;(7)伴呼吸困难,患侧胸廓饱满。
胸痛伴有下列任一情况者,应当尽快进行监护,并完善相关检查:(1)长期卧床、长途旅行者,突发胸痛且持续不缓解;(2)确诊肿瘤、下肢静脉血栓者突发胸痛且持续不缓解;(3)既往无冠心病史,突发胸痛伴有喘憋;(4)伴咯血;(5)近4周内有手术,并有制动史;(6)合并多种心血管病高危因素;(7)长期高血压控制不佳。
下列胸痛患者可常规就诊:(1)不伴有上述情况的胸痛;(2)有胸壁压痛的胸痛;(3)与呼吸相关的胸痛;(4)超过一周的轻度胸痛。
2.致命性胸痛的判断
接诊胸痛患者后,除关注患者血流动力学、心脏电活动外,还应注意胸痛持续时间,结合病史、症状、查体、辅助检查等快速识别高危ACS、AAD、APE、张力性气胸等致命性胸痛疾病。
3.中低危胸痛的诊断与评估
在中低危胸痛鉴别诊断中,应综合考虑各种疾病可能,包括心源性和非心源性疾病。诊断与评估策略如下:
(1)对于所有患者,均应立即行心电图检查。
(2)对于诊断不明确的患者,应选择合适的POCT或影像学检查,并根据病情复查心电图等。
(3)对于症状提示为非心源性胸痛的患者,需要鉴别的疾病至少包括以下病种:①呼吸系统疾病:气胸、胸膜炎、胸膜肿瘤、肺部感染等;②消化系统疾病:胃食管反流病、自发性食管破裂、食管动力疾病、食管裂孔疝、食管癌等;③胸壁疾病:急性肋软骨炎、肋骨骨折、胸椎疾病、带状疱疹和肿瘤等;④神经精神疾病:颈椎/脑血管疾病、神经官能症等;⑤纵隔疾病:纵隔气肿、纵隔肿瘤、纵隔炎等;⑥其他:强直性脊柱炎、急性白血病、多发性骨髓瘤等。
(4)对于再次评估为中低危的胸痛患者,应科学救治、及时分流,安排患者住院、离院或专科就诊。
(5)对于未完成全部评估而提前离院的胸痛患者,接诊医师应告知其潜在的风险、症状复发时的紧急处理和预防措施等事项,签署并保存相关医疗文书。
(6)ACS、AAD、APE等疾病需长期服药、逐步康复和防治复发,建议针对此类疾病可建立院内专病随访中心(有条件的医院鼓励开展门诊面访),统一管理、登记、指导,做到包括预防、救治、康复在内的患者“全程管理”。
(7)对于从急诊完成评估的中低危胸痛患者,医师应根据病情制定后续诊疗和随访计划,有专职医护人员定期开展电话随访工作并有完善的随访记录,开展健康宣教。
应选择哪些辅助检查?
1.心电图
所有患者在首次医疗接触后应尽快完成常规十二导联心电图,必要时需加做后壁、右室导联并根据病情及时复查。
心电图是诊断ACS的主要检查手段,建议首次医疗接触后10min内完成心电图并需根据临床情况及时复查。
部分气胸患者心电图可表现为顺钟向转位、左胸导联QRS低电压现象。右侧气胸最突出的表现是QRS电压与呼吸周期呈一致性变化,通常称“电压交替”。
2.实验室检查
即时检验(POCT)是急性胸痛急诊诊疗的重要工具之一。
(1)心肌损伤标志物
目前诊断缺血性胸痛常用的心肌损伤标志物包括心肌肌钙蛋白(cTn)、肌酸激酶同工酶(CKMB)和肌红蛋白(MYO)。
高敏cTn(hs-cTn)的敏感度更高,常用来早期筛查及排除诊断。当不能测定cTn时,可选择CK-MB做为诊断AMI的重要指标。
表1 常用心肌损伤标志物特点

(2)心脏功能标志物
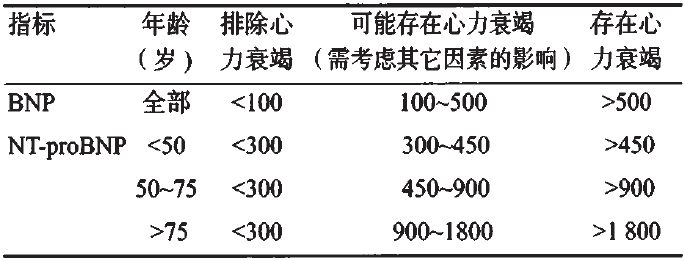
利钠肽在急性胸痛的鉴别诊断、危险分层和预后判断等方面也具有重要作用。BNP和NT-proBNP是目前最重要的心脏功能标志物。
表2 BNP及NT-proBNP诊断心力衰竭临界值(pg/mL)
(3)出凝血标志物
D-二聚体可作为APE诊断的首选筛查指标,D-二聚体<500 μg/mL的可疑病例,如无法进行影像学检查,应动态检测D-二聚体水平。
D-二聚体检测还可用于主动脉夹层的筛查和排除,研究发现以500 μg/mL作为临界值,其检测敏感度为97%,阴性预测值为96%,特异性为56%,阳性预测值为60%。
(4)胸痛相关炎性标志物
在AMI的患者中,CRP高峰可持续48h,且高峰值与心梗面积有关。同时,CRP>7.9 mg/L时还预示着AMI后心脏收缩及舒张功能障碍,左室充盈压力的升高,远期心力衰竭发生率及病死率的增高。
MPO升高提示冠状动脉易损斑块炎症反应,可做为稳定型缺血性心脏病和AMI的标志物。降钙素原(PCT)主要用于鉴别患者是否并发感染。
(5)动脉血气分析
高危胸痛患者可通过血气分析快速评估患者循环灌注情况,指导是否紧急处理;并可根据电解质水平及时对症处理,预防恶性心律失常的发生。
动脉血气分析常用来鉴别APE,多数APE患者PaO2<80 mmHg伴PaCO2下降。
(6)血生化
血生化包括血清内各种离子、糖类、脂类、蛋白质以及酶、激素和机体的多种代谢产物。部分临床药物的应用需根据肝肾功能调整方案,K+、Mg2+等电解质水平与恶性心律失常风险相关,胆固醇的基线水平将指导调脂药物的使用。
(7)生物标志物联合应用
所有急诊接诊的急性非创伤胸痛患者,如果存在高危胸痛的危险因素及发病特征,且出现以下三种情况中的至少一种时,即血流动力学不稳定、心电活动不稳定或心力衰竭,应及时对症处理,且尽早联合检测心肌损伤标志物(表3)、BNP/NT-proBNP及D-二聚体。
表3 心梗三项联合判读

如果没有上述三种情况,可根据具体病因考虑,有针对性的检测一类或两类指标完成疾病的诊断或鉴别诊断,确诊后再联合其他检测指标实现危险分层和预后判断。
3.床旁超声心动图
床旁超声心动图能清晰显示心脏、大血管的结构和功能,为胸痛的鉴别诊断提供重要信息。
(1)急性心肌梗死
超声心动图可判断心肌是否存在节段性室壁运动异常,有助于ACS的鉴别、诊断。
超声心动图能评估发生缺血的心肌的范围、程度,还能发现心肌缺血引起的一系列并发症,如缺血性二尖瓣反流、乳头肌断裂、室间隔穿孔及室壁瘤、附壁血栓等,同时还能评估心脏的功能。
(2)急性主动脉夹层
超声表现为主动脉腔内出现飘摆颤动的线性回声,剥脱的内膜将管腔分为真腔与假腔两个部分。
超声可直观显示内膜剥离的范围、程度、破口位置、主动脉内径。除此之外,还可以显示AD相关并发症,包括重度主动脉瓣反流、心包填塞等,有助于临床医生选择最佳的手术时间及手术术式。
(3)急性肺栓塞超声
直接征象为发现肺动脉近端或右心腔血栓;间接征象多是右心负荷过重的表现,主要为右室和(或)右房的扩大、室间隔运动异常、三尖瓣反流、肺动脉压力增高及肺动脉主干和分支扩张等。
如果二维超声心动图没有发现右心功能负荷过重或功能紊乱,一般不考虑严重的急性肺栓塞。下肢血管超声检查有助于筛查肺栓塞的栓子来源。
4.X线检查
X线检查是诊断气胸最常用的方法,可显示肺萎缩程度、胸膜粘连、纵隔移位及胸腔积液等。
气胸侧透明度增强,无肺纹理,肺萎缩于肺门部,和气胸交界处有清楚的细条状肺边缘,大量气胸时纵隔可向健侧移位,尤其是张力性气胸更显著;少量气胸则占据肺尖部位,使肺尖组织压向肺门;如有液气胸则见液平面。
5.CT及CT血管造影(CTA)检查
(1)气胸
可通过CT检查明确诊断,CT对胸腔内少量气体的诊断较为敏感。对反复发作的气胸、慢性气胸患者观察肺边缘是否有造成气胸的病变,如肺大疱、胸膜带状粘连,肺组织牵拉、裂口不易闭合等。气胸表现为胸膜腔内出现极低密度的气体影,伴有肺组织不同程度的压缩。
(2)急性主动脉夹层
可通过CTA明确诊断,敏感性达90%以上、特异性接近100%,主要表现包括:血管直径增大征或巨大的夹层动脉瘤;血管内膜征,主动脉管腔内发现动脉内膜片提示夹层或壁间血肿;钙化点征,正常主动脉钙化点一般在主动脉外周,当血管内出现内移的钙化点,提示内膜片内移。
CTA检查可显示主动脉真、假腔和血管直径,还包括内脏动脉位置和假腔内血栓情况,是临床最常用的辅助检查方法。
(3)肺栓塞
可通过CTA明确诊断,但对于亚段及外周肺动脉的栓子其敏感性有限。资料显示,CTA对于PE诊断的敏感性为53%~100%,特异性为78%~100%。
常见高危胸痛如何救治?
1.急性冠脉综合征
(1)急性ST段抬高型心肌梗死(STEMI)
怀疑STEMI的患者要尽快完成心电图、POCT、床旁超声等辅助检查。需根据病情复查心电图、POCT等。
明确STEMI的患者可根据现实条件选择合适的再灌注策略,包括直接PCI(PPCI)、转运PCI或静脉溶栓治疗、溶栓后转运PCI和溶栓-介入序贯再灌注治疗等。
(2)非ST段抬高的急性冠脉综合征(NSTE-ACS)
由于NSTE-ACS患者的病情严重程度差异大,应建立基于危险分层的治疗策略,根据病情危险程度分层施治,常用的评分模型包括GRACE风险评分和TIMI风险评分。
初步评估或再次评估明确为极高危的患者,应在2h内实施紧急介入治疗,对高危患者指南建议选择24h内行早期介入治疗,对于症状或缺血反复发作的中危患者可在72h内选择介入治疗。
一旦NSTE-ACS进展为STEMI,应立即按STEMI再灌注治疗流程执行后续治疗。评估为高危或中危患者诊疗流程,需按规定时间内接受早期或延迟介入治疗或及时转运。
(3)ACS合并急性心力衰竭(AHF)的早期预警
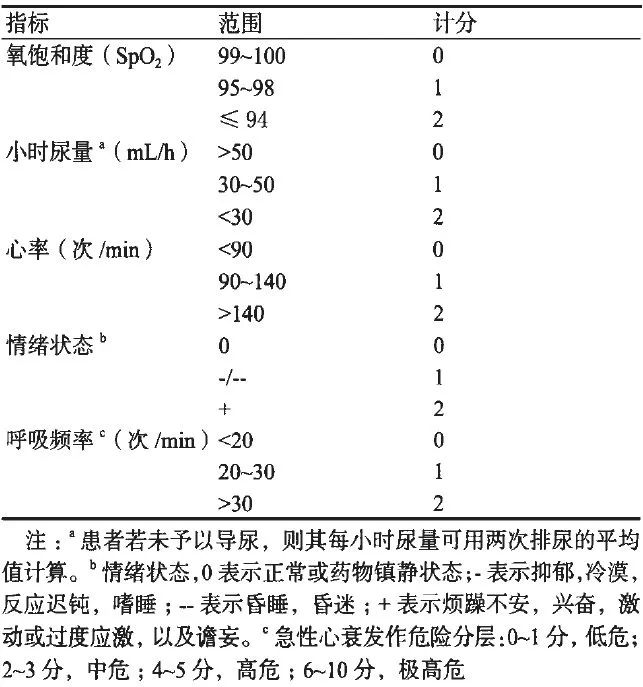
推荐高危ACS患者采用“急性心衰早期预警Super-score评分系统”,即以氧饱和度(S)、小时尿量(U)、心率(P)、情绪状态(E)呼吸频率(R)这5个指标组成的Super-Score评分模型为指导,动态监测高危患者病情变化,总分10分,建议高危患者每小时评分1次,理论上提前2~6h预测患者急性心衰发作,以此为指导可以开展急性心衰的早期预警、提前干预。
表4 急性心衰早期预警Super-score评分系统
(4)ACS的药物治疗
抗栓是ACS药物治疗的基石,明确诊断并排除出血后需立即启动抗栓治疗,临床上应综合评估患者的缺血和出血风险,制定个体化的抗栓策略。
再灌注、抗栓治疗的同时,改善心肌微循环、抗心肌缺血、防治心室重构等也是改善ACS患者症状和预后的重要手段。
2.急性主动脉夹层
经临床初步评估高度怀疑AAD的患者,应立即入胸痛诊间进行监护,限制活动,并尽快完成体格检查。同时,需尽快完成血常规及血型、血气分析、心肌损伤标志物、凝血功能、血生化等检测,以辅助诊断并为手术治疗做准备。
应尽快给予有效镇痛(可适当肌注或静脉应用阿片类药物)、控制心率和血压(建议静脉应用β受体阻滞剂),控制夹层发展,降低主动脉夹层破裂的风险。理想控制目标为心率60~80次/min和收缩压100~120 mmHg。
尽快完成床旁心电图、超声心动图等辅助检查。在有效镇痛、心率血压控制稳定后,尽快完成主动脉CTA检查,明确急性主动脉夹层的分型及受累范围,为手术方案的选择提供依据。
3.急性肺栓塞
APE患者入院后须尽快完成心电图检查,并行血气分析、D-二聚体、BNP、cTn等检测。有条件的医院应尽快完成肺动脉CTA,以明确诊断并危险分层。
根据Wells评分或PESI分级等评估手段动态评估患者,对于高危肺栓塞患者,应尽快完成床旁超声检查,尽快进行抗凝治疗。对于排除溶栓禁忌证的患者,及时给予静脉溶栓治疗。有溶栓禁忌证者应考虑导管碎栓、溶栓或手术取栓;连续动态监测血压,限制活动。
中低危组:应住院或门诊抗凝治疗,并密切观察、动态评估病情,依据凝血指标调整抗凝药物的剂量,既保证抗凝药物的有效性,又尽量减少出血。
4.张力性气胸
所有考虑张力性气胸的患者,均应当立即进入胸痛诊间或抢救室,待确诊后应立即施行胸腔穿刺术(穿刺位置常为患侧锁骨中线第2肋间,可使用粗针头穿刺排气),予紧急排气、减压。
穿刺减压同时需进行床旁X线或胸部CT检查;若条件允许,亦可先行胸腔闭式引流术,再行相关检查。若医疗机构不具备胸腔闭式引流术条件,应当对张力性气胸患者实施紧急胸腔穿刺减压后转诊。
文献索引:中华医学会急诊医学分会, 中国医疗保健国际交流促进会胸痛分会. 急性胸痛急诊诊疗专家共识. 中华急诊医学杂志, 2019; 29(4): 413-420.
来源:医脉通临床指南